





来源:「水凝胶」微信公众号|
发表时间:2020-11-14
点击:6896
【前言背景】
生物电子设备的可靠功能需要与生物组织保持一致,稳定和导电的界面。生物电子设备与组织的整合通常依赖于物理附着或手术缝合。然而,这些方法面临诸如非适形接触,固定不稳定,组织损伤和/或疤痕形成的挑战。
【科研摘要】
最近,南方科技大学郭传飞副教授联手麻省理工学院赵选贺教授团队报告了一种基于石墨烯纳米复合材料薄层的电子生物粘合界面,该界面可以提供快速(5秒内形成粘合),牢固(界面韧性> 400 Jmm-2)和按需可拆卸地集成生物电子设备。电子生物粘附界面的电导率(> 2.6 S m-1)进一步允许双向生物电子通信。该文展示了基于离体猪和体内大鼠模型的电子生物粘附界面的生物相容性,适用性,机械和电稳定性以及记录和刺激功能。这些发现为改善组织-设备集成和增强生物集成电子设备的性能提供了一种有前途的策略。相关科研成果Electrical bioadhesive interface for bioelectronics发表在自然旗下的《Nature Materials》上。
 "
"
【图文解析】
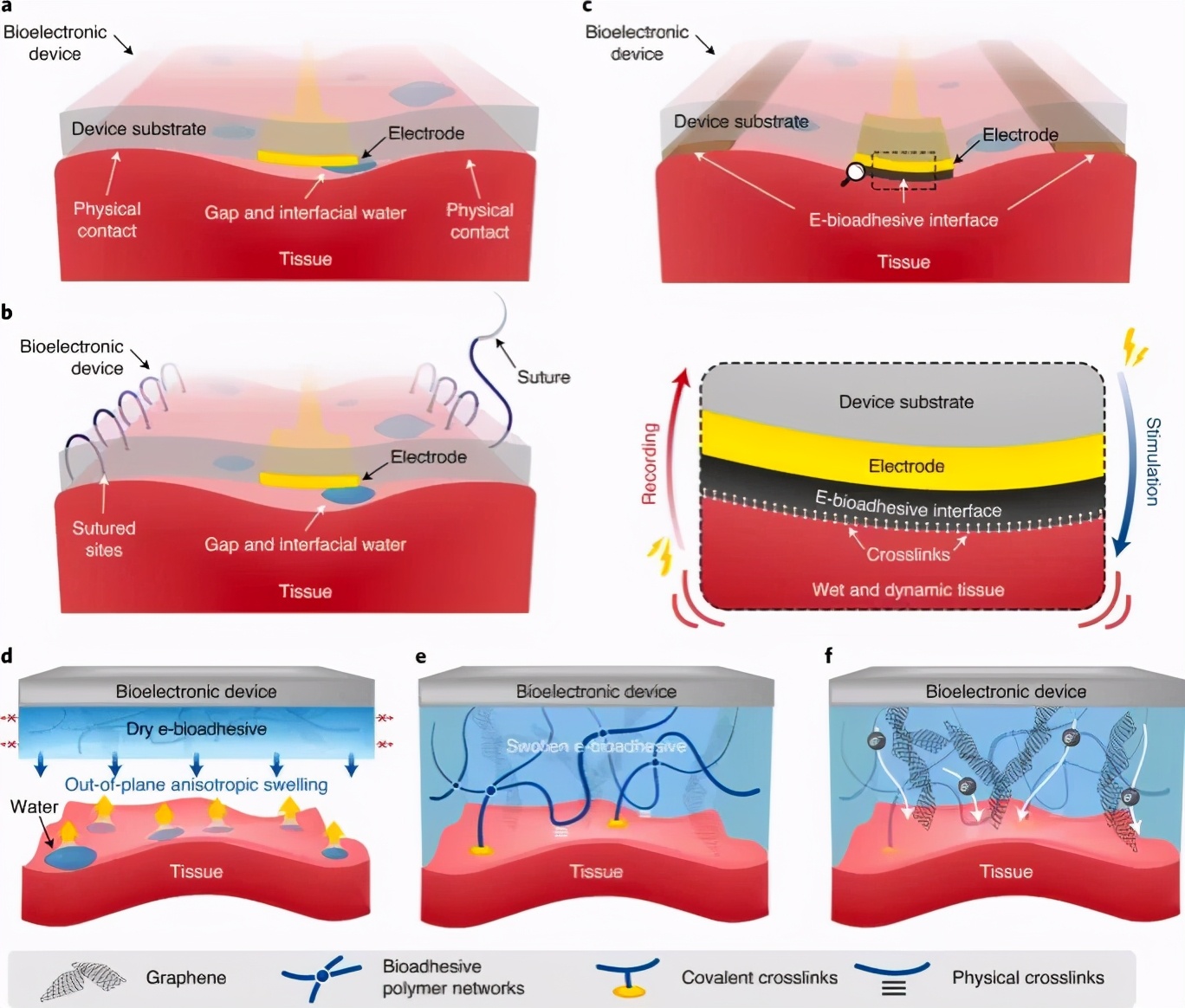
与小型化和柔性电子学的最新进展相结合,已在广泛的诊断和治疗应用中深入研究了与生物组织紧密接触的生物电子设备的集成。为了确保生物电子设备在这些应用中的可靠功能,至关重要的是在设备与目标组织之间建立共形和稳定的接触。尽管已经证明了柔性生物电子设备在组织上的物理连接,但这种连接通常限于厚度小于5μm的薄设备。此外,由于物理连接依赖于相对较弱的键,例如范德华相互作用或毛细管现象,这些薄设备可能仍然从湿的动态组织中脱粘,特别是在长期应用中(图1a)。
 "
"
图1:电子生物粘附界面的设计和机理。
为了更稳定地集成生物电子设备,特别是非薄膜形式的设备,已经采用了通过缝合线进行的常规外科手术固定。然而,缝合会导致组织损伤和应力集中在刺穿点,并因此形成疤痕(图1b)。作者报道了一种电子生物粘附(e-bioadhesive)界面,以实现生物电子设备与各种湿动态组织之间的快速,坚固,保形和导电整合(图1c)。电子生物粘附界面由石墨烯纳米复合材料的薄层实现,可以很容易地将生物电子设备粘附到湿的动态组织表面。当干燥的电子生物粘附界面接触湿的组织表面时,电子生物粘附界面通过水合作用去除水分,随后各向异性(仅在厚度方向)膨胀,从而在5s内与组织表面形成快速而牢固的整合(图1d,e)。粘附在组织表面后,电子生物粘附界面变成具有高水含量,柔软性和可拉伸性的石墨烯纳米复合水凝胶薄层,与柔软的生物组织的机械性能相匹配。如果电子生物粘附界面位于生物电子设备的电极上,则可以使其具有导电性,从而可以对下层组织进行电记录和刺激(图1f)。
电子生物粘附界面的设计与机理
首先将氧化石墨烯(GO)引入聚乙烯醇(PVA)水凝胶中,以制备表现出各向异性溶胀(主要是正交于粘合界面的溶胀)的石墨烯纳米复合水凝胶。GO-PVA水凝胶进一步与接枝了N-羟基琥珀酰亚胺酯(PAA-NHS酯)的聚丙烯酸的交联网络互穿,以提供生物粘附能力(图1d)。然后,我们通过在要粘附到组织的生物电子设备的位置上干燥所得的GO-PVA-PAA-NHS酯水凝胶来准备电子生物粘附界面。生物电子设备的表面被伯胺基团官能化,以促进与电子生物粘附界面的共价交联(图1e)。如果将电子生物粘合剂界面放置在设备的电极上,则可以在引入生物粘合剂PAA-NHS酯网络之前将GO-PVA水凝胶进一步还原为rGO-PVA水凝胶。GO导致导电性,而不因为还原条件采用这里原因PVA网络内和PVA和GO之间致密基于氢键的物理交联的干扰最小损害机械特性的降低(图1F)。
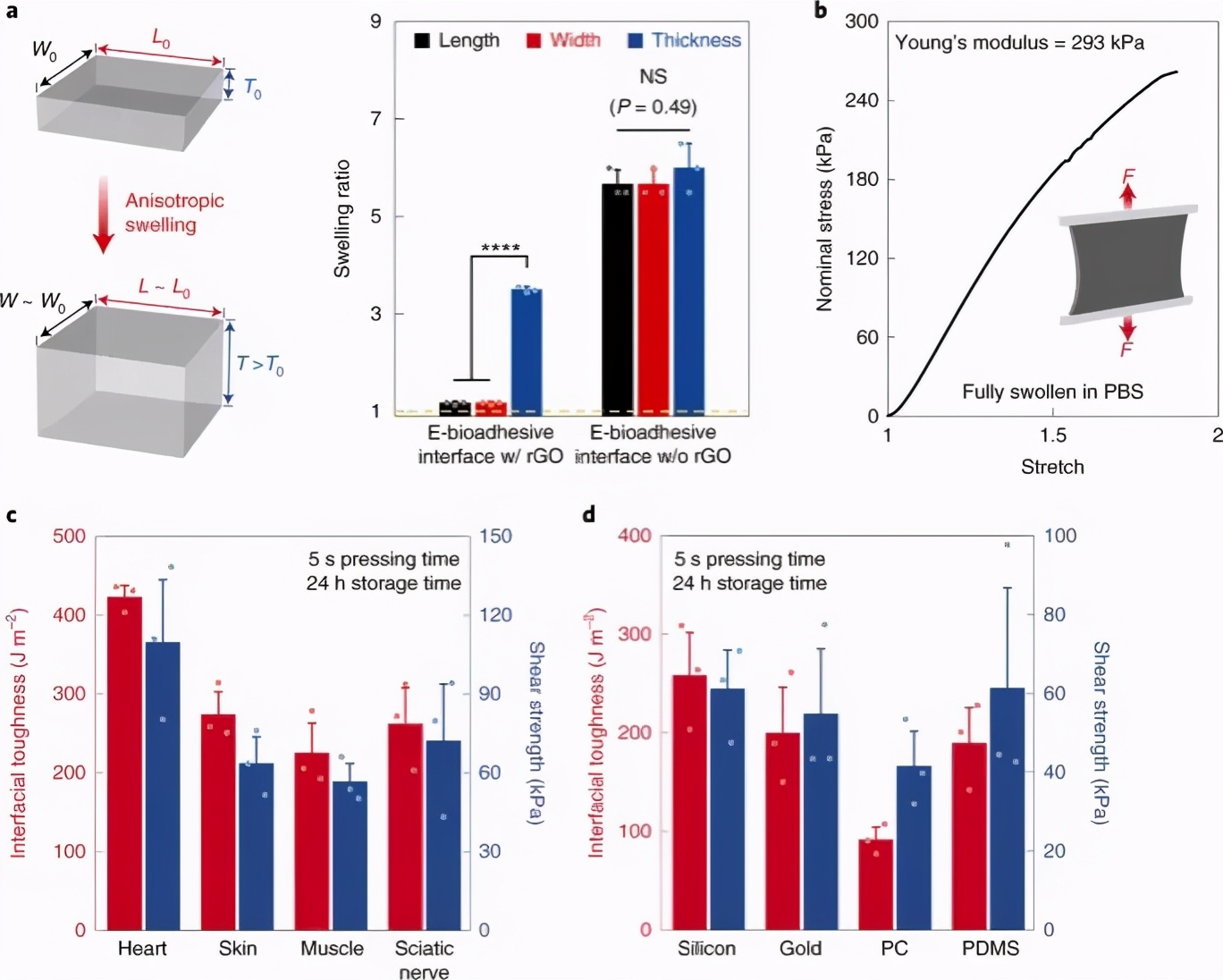
在粘附形成过程中,干燥的电子生物粘附界面会吸收水,并且各向异性地垂直于粘附界面膨胀(厚度增加3.6倍),而长度和宽度增加到其初始值的1.1倍以下(图2a)。在完全膨胀至其平衡状态后,电子生物粘附界面没有进一步的尺寸变化。电子生物胶粘剂界面的各向异性溶胀源自其制备中使用的受基材约束的干燥过程,其中rGO-PVA微结构的形成限制了电子生物胶粘剂沿面内的溶胀方向(图2a)。在湿润的组织上形成粘附力后,肿胀的电子生物粘附界面变成水凝胶薄层,具有组织状的高含水量(约占体积的85%),柔软度(杨氏模量293 kPa),可拉伸性(> 2)和高韧性(断裂韧性为1,126 J m-2)(图2a,b)。
 "
"
图2:电子生物粘附界面的机械性能。
附着力
为了评估电子生物粘附界面的粘附性能,作者进行了标准的机械测试,以测量所粘附的各种组织和设备材料的界面韧性(180°剥离测试,ASTM F2256)和剪切强度(搭接剪切测试,ASTM F2255)。通过电子生物粘附界面。具有聚酰亚胺背衬的电子生物粘附界面可对各种湿润组织形成快速而牢固的粘附,具有较高的界面韧性(对于心脏而言> 420> J m-2;对于皮肤而言> 270 J m-2;对于肌肉> 230 J m-2;在施加轻微压力(〜1)的5s内,坐骨神经> 260 J m−2)和高剪切强度(心脏> 110 kPa;皮肤> 60 kPa;肌肉> 50 kPa;坐骨神经> 70 kPa) kPa)(图2c)。电子生物粘附界面还可以在湿纸巾和各种常用的具有高界面韧性的设备材料之间提供快速而牢固的粘附(硅> 250 J m-2;金> 190 J m-2;> 200 J m-2聚二甲基硅氧烷(PDMS);聚碳酸酯(PC)> 90 forJ m-2)和高剪切强度(硅> 60> kPa;金> 50 kPa; PC> 40 kPa; PDMS> 60 kPa)(图 2d)。
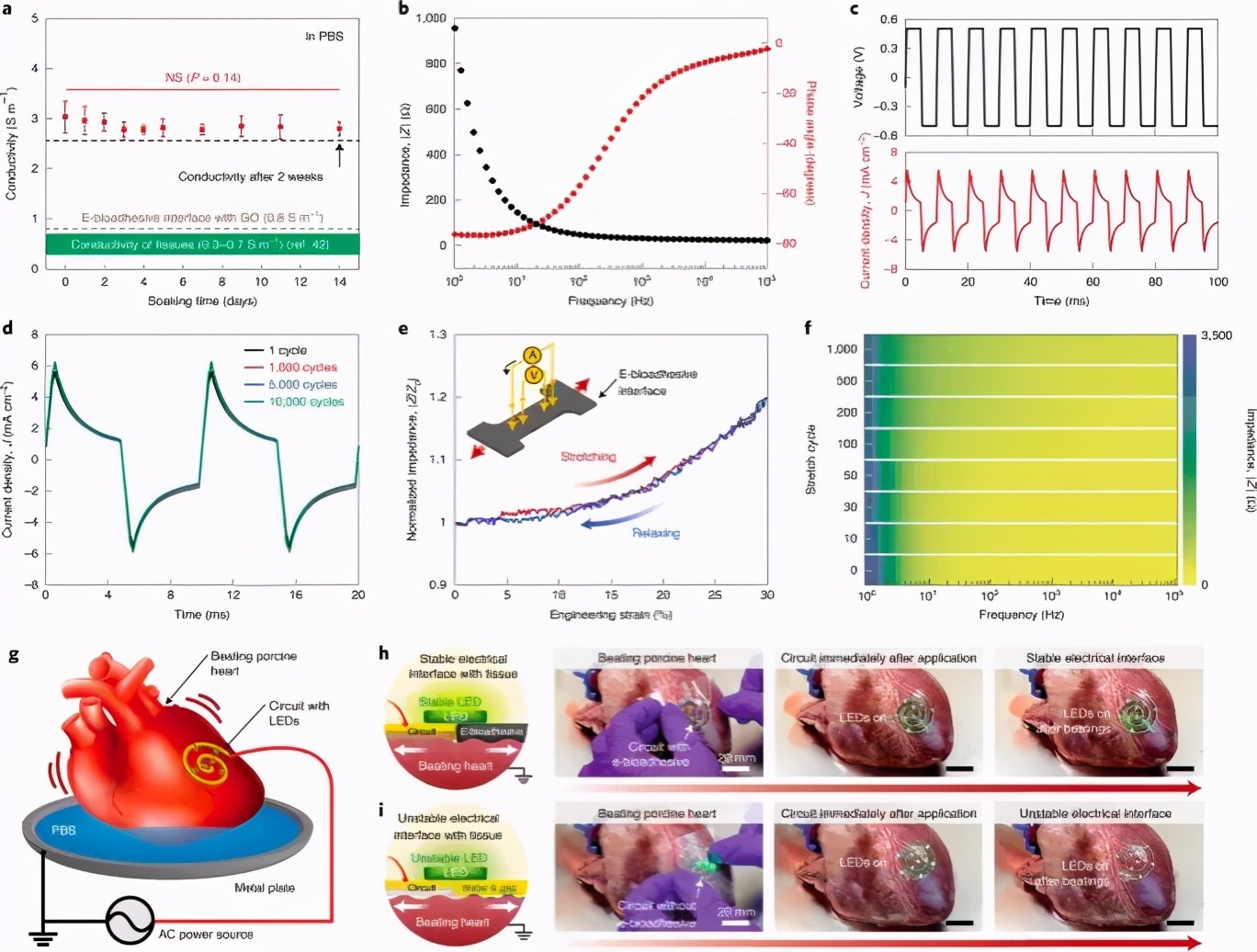
电性能
了在生物电子设备和下面的组织之间提供不受阻碍的电通信,设备电极上电子生物粘附界面的存在不应实质上改变组织-电极界面的电特性。通过将纳米复合水凝胶中的GO减少到rGO(图3a),可以轻松地修改电子生物粘附界面以赋予导电性。
 "
"
图3:电子生物粘附界面的电性能。
在37°C的PBS中孵育14天,无论有无内源酶(例如胶原酶),电子生物粘附界面均显示稳定的电导率> 2.6 S m-1。电子生物粘附界面的电导率明显高于生物组织(0.3-0.7 S m-1)(图3a)。薄的厚度(<100μm)和电子生物粘附界面的保形粘附可以分别进一步降低互连性和接触电阻。在102-105 Hz的生理相关频率下,电子生物粘附界面显示出低阻抗(<50ω)(图3b),从而最大程度地减少了设备-组织界面处的电阻抗的不利增加。进一步表征了电子生物粘附界面的电荷注入能力(cic),以评估其对生物电子设备的电刺激功效的影响(图3c)。在10,000次充放电循环后,电子生物粘附界面的cic值降低了5%(图3d)。此外,在生理相关应变水平下的周期性拉伸变形过程中,e-生物粘附界面的平面外阻抗表现出可忽略的滞后性(图3e)和波动(图3f)(例如30%的拉伸工程应变),进一< span="">步支持了在动态生理条件下电子生物粘附界面的稳定性。
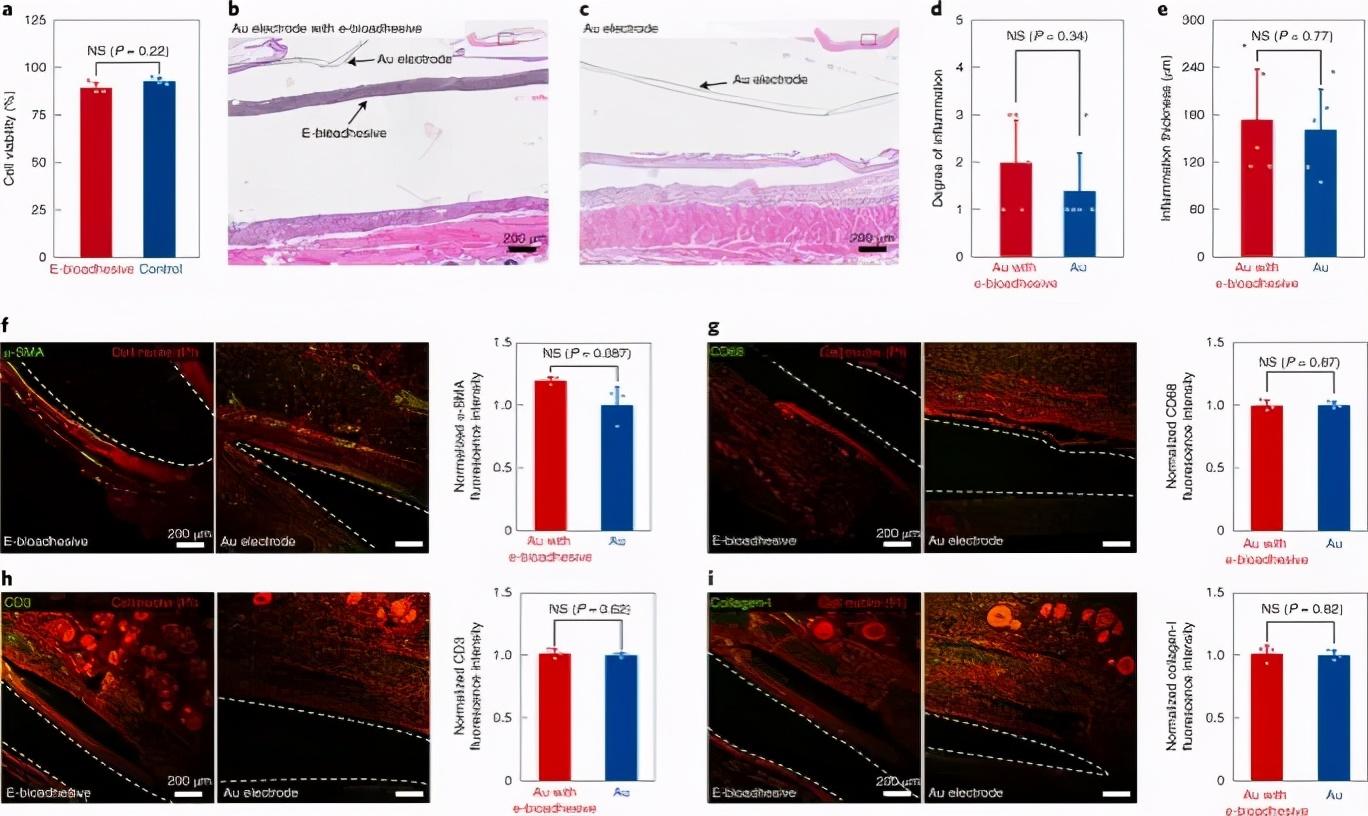
生物相容性
为了评估电子生物粘附界面的生物相容性,我们基于大鼠模型进行了一系列体外和体内表征(图4)。培养24小时后,具有e-生物粘附界面的细胞培养基(Dulbecco改良的Eagle培养基,DMEM)显示出与对照(原始DMEM)相比大鼠心肌细胞的体外细胞毒性(图4a)。基于大鼠模型皮下背侧植入14天,进一步评估了电子生物粘附界面的体内生物相容性(图4b,c)。盲法病理学家进行的组织学评估表明,植入和植入后14天,有和没有电子生物粘附界面的金电极均显示出类似的组织反应,而没有严重的炎症反应(P = 0.34,图4d)。此外,在有和没有电子生物粘附界面的情况下,金电极之间的炎症厚度没有显着差异(P = 0.77)(图4e)。
 "
"
图4:电子生物粘附界面的体外和体内生物相容性。
生物电子功能
作者还发现,与在PBS中孵育1天和14天的样品相比,在14天后体内植入的样品的电导率,阻抗和界面韧性没有统计学差异(P> 0.05),证明了电子生物粘附界面的体内稳定性(图5)。
为了评估e-生物粘附界面的体内生物电子功能,作者记录了原位心外膜心电图(ECG,图5a–c),并通过金电极与e-电极电刺激了坐骨神经(图5d–h)。基于大鼠模型的生物粘附界面。为了记录心外膜心电图,将阳极和阴极生物粘附电极(具有e-生物粘附界面的金电极)分别应用于大鼠心脏的右心房和心尖(图5a)。同时,还通过使用常规的针状电极记录表面心电图,以评估心外膜心电图的质量并监测由生物粘附电极产生的可能的心律不齐。电子生物粘附界面的快速而牢固的粘附力使电极在接触和轻轻按压后几秒钟内就能牢固地粘附于跳动的大鼠心脏表面。通过轻轻拉动粘附的电极,然后通过该电极举起整个心脏,进一步验证了坚固的整合性(图5b)。
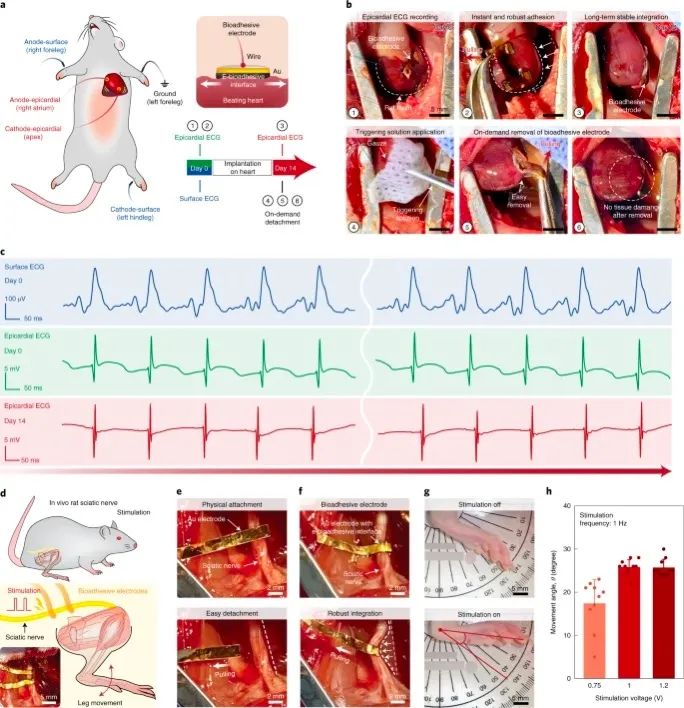 "
"
图5:通过电子生物粘附界面进行体内记录和刺激。
一旦生物粘附电极粘附到心外膜组织上,电子生物粘附界面就可以稳定记录心外膜心电图,而没有可观察到的基线跳动或来自跳动大鼠心脏的高振幅噪声(图5b,c)。值得注意的是,表面ECG并未显示出任何可观察到的由生物粘附电极引起的心律不齐的迹象,这证明了电子生物粘附界面与电活性组织和器官(如心脏)的相容性。体内植入14天后,生物粘附电极与大鼠心脏保持牢固的整合,并允许记录心外膜ECG信号,其波形和信噪比与植入生物粘附电极后立即记录的心外膜ECG信号相当在第0天(图5b,c),验证了电子生物粘附界面的体内稳定性和功效。利用电子生物粘附界面40的可触发分离能力,进一步证明了在体内植入14天后按需无创性去除粘附的生物粘附电极(图5b)。
【总结展望】
生物粘性导电界面的提出,实现了生物电子设备与多种体内组织的高强度粘合,双向电生理信号的传导以及无创的脱粘附。相较于传统的手术缝合和物理贴合等集成方式,具有巨大的潜力。本文提出的材料,方法和概念,不但解决了长期以来生物组织与植入设备在集成方法上的困难和挑战,同时也为一系列生物可粘附电子器件的发展和人机融合交互的方式提供了新的机遇和思路。
参考文献:
doi.org/10.1038/s41563-020-00814-2
版权声明:「水凝胶」是由专业博士(后)创办的非赢利性学术公众号,旨在分享学习胶体高分子科学的研究进展及科研信息。上述仅代表作者个人观点且作者水平有限,如有科学不妥之处,请予以下方留言更正。如有侵权或引文不当请联系作者改正。商业转载请联系编辑或顶端注明出处。感谢各位关注!
“本文由新材料在线®平台入驻媒体号「水凝胶」微信公众号提供,观点仅代表作者本人,不代表本网站及新材料在线®立场,本站不对文章内容真实性、准确性等负责,尤其不对文中产品有关功能性、效果等提供担保。本站提醒读者,文章仅供学习参考,不构成任何投资及应用建议。如需转载,请联系原作者。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间处理!本站拥有对此声明的最终解释权。”

